I. ANATOMIA ARTERIAL CORONARIA
As artérias coronárias:
PARA DEFINIR A DOMINÂNCIA DE CIRCULAÇÃO NO CORAÇÃO
- clinicamente: a fonte da ADP
- anatomistas a definem com base em onde nasce a artéria sinoatrial
I. CORONARIA ESQUERDA:
-
nasce do seio coronário esquerdo;
-
2 cm de comprimento (variando de 1 a 4 cm)
-
trajeto entre a artéria pulmonar e a auriculeta esquerda,
-
se bifurca em dois ramos principais:
- artéria coronária descendente anterior esquerda (DAE)
- artéria coronária circunflexa esquerda (CxE)
ABERRAÇOES:
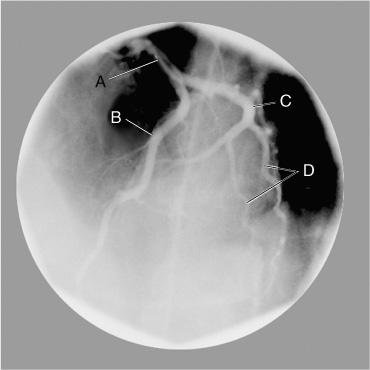
Tronco da artéria coronária esquerda (A), artéria coronária descendente anterior esquerda (B), artéria circunflexa esquerda (C) e vasos obtusos marginais (D).
DAE irriga: as porções anterior e lateral esquerda do ventrículo esquerdo.
A DAE dá origem a inúmeros ramos perfurantes para o septo interventricular anterior. Na maioria dos casos, a DAE enrola-se ao redor do ápice cardíaco e faz uma anastomose com a artéria descendente posterior (ADP), um ramo da artéria coronária direita (ACD). Conforme a DAE acompanha o sulco interventricular, ela pode dar origem a um ou mais ramos que fazem um trajeto diagonalmente sobre a parede livre anterior do ventrículo esquerdo.
nascem a partir da DAE:
- o primeiro ramo diagonal
- a primeira perfurante septal
os maiores vasos que tanto as septais quanto as diagonais tornam-se menores conforme os vasos progridem distalmente.
CORONARIA CIRCUNFLEXA
A CxE origina-se do TCE e segue um trajeto posterior sob a auriculeta esquerda e ao longo do sulco atrioventricular (AV) esquerdo.
Na maioria dos casos, a circunflexa termina como um ramo obtuso marginal.
No entanto, ela pode ser a fonte primária do fluxo sanguíneo para a ADP (artéria descendente posterior). Um a quatro ramos marginais obtusos de tamanhos variáveis emergem da artéria circunflexa principal e fazem um trajeto ao longo dos aspectos lateral e póstero-lateral do ventrículo esquerdo. Os ramos que nascem mais distalmente, não raro, são denominados ramos póstero-laterais da artéria circunflexa. Estes ramos fazem um trajeto paralelo ao da ADP, mas não fornecem nenhum ramo perfurante para dentro do septo interventricular.
Circulação com dominância esquerda: 10% dos pacientes:
artéria circunflexa supre as artérias descendente posterior e do nódulo AV,
II. CORONARIA DIREITA
ORIGEM:
óstio no seio coronário direito
Bifurca-se:
- artérias descendente posterior
- póstero-lateral direita
Areas de irrigação:
- a maior parte do ventrículo direito
- a parte posterior do ventrículo esquerdo
- múltiplos ramos ventriculares direitos (marginais agudos)
- ramos para o nódulo AV
Provém da ACD proximal:
- artéria do nódulo sinoatrial
- artéria do nódulo AV (90%)
- outros pequenos ramos atriais
- artéria marginal aguda
- ramos ventriculares anteriores
Em aproximadamente 90% dos pacientes, a ACD passa através do sulco AV para o sulco interventricular posterior e torna-se a ADP. Este padrão de circulação é denominado sistema com dominância direita.
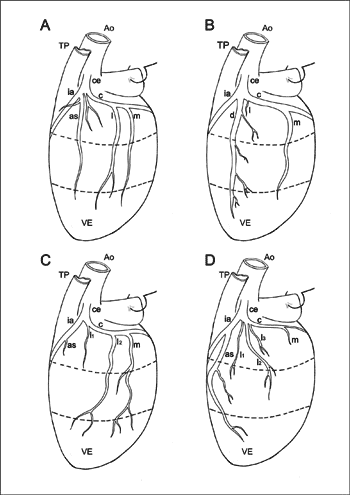
Representação esquemática da complementaridade dos ramos ântero-superior, diagonal e lateral, em vista lateral esquerda do coração (4 casos; em A, B e D: dominância da artéria coronária direita; em C: tipo de circulação coronariana balanceada). A aurícula esquerda foi rebatida.
A. Coexistência dos três ramos: ântero-superior (as) longo, diagonal (d) curto e lateral (l) longo.
B. Coexistência de um ramo diagonal longo com um ramo lateral curto.
C. Neste caso há dois ramos laterais, um curto (l1) e um longo (L2), ao lado de um ramo ântero-superior curto.
D. O ramo ântero-superior longo é ladeado por três ramos laterais: dois médios (l1 e l2) e um curto l3). Ao= aorta; TP= tronco pulmonar; VE= ventrículo esquerdo. ce= artéria coronária esquerda; ia= ramo interventricular anterior; c= ramo circunflexo; m= ramo marginal esquerdo; cd= artéria coronária direita.
Ocasionalmente, a ADP surge tanto a partir da ACD quanto da ACxE e a circulação é considerada como codominante
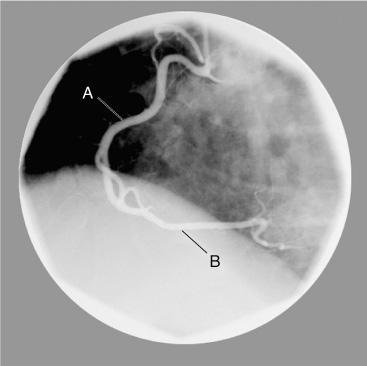
Artéria coronária direita (A) e artéria descendente posterior (B)
As anomalias congénitas podem ser ou não significativas:
As anomalias hemodinamicamente significativas podem resultar em perfusão coronariana anormal - incluem:
CIRCULAÇÃO CORONARIANA E REGULAÇÃO DO FLUXO SANGUÍNEO
Fluxo Sanguíneo Coronariano
troca transcapilar: liberação do oxigénio e outros substratos metabólicos para o miocárdio e remoção do dióxido de carbono e os produtos da degradação metabólica
O miocárdio apresenta elevada taxa de utilização energética.
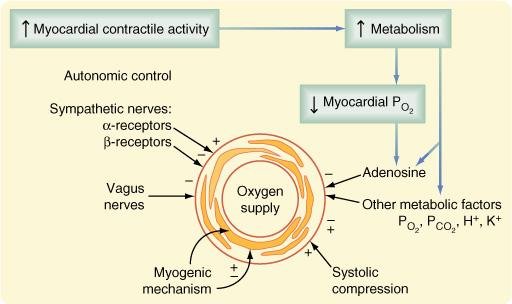
FATORES QUE INFLUENCIAM NA RESISTÊNCIA VASCULAR CORONARIANA
A) Metabólicos
É o regulador primário do fluxo sanguíneo coronariano é o metabolismo miocárdico local mesmo:
Entre a atividade metabólica miocárdica e a magnitude das modificações no fluxo sanguíneo coronariano existe uma relação muito forte.
Hipótese provável:
O FENÓMENO DA HIPEREMIA REATIVA
Significância: Se um vaso sanguineo for obstruido, depois a desobstrução o fluxo sanguineo excede o nivel basal e volta somente depois um tempo que e proporcional com a duração da obstrução.
Mediadores da hiperemia reativa:
Dentre todos, a adenosina parece a ter um papel muito importante.
A degradação do ATP produz adenosina, um potente vasodilatador. Ela acumula-se no espaço intersticial e libera o músculo liso vascular.
Efeitos:
Em contradição vem o fato que os antagonistas do receptor da adenosina (cofeina, por exemplo), não bloqueiam completamente a hiperemia reativa - provavelmente ela pode ser apenas parte do processo.
O óxido nítrico (ON) parece a ser, tambem, muito importante, já que, na ausência de endotélio, uma das fontes de produção de ON, as artérias coronárias não sofrem auto-regulação.
B) Físicos
Um fator chave responsável pela perfusão é a pressão aórtica. Através do processo de auto-regulação vasculatura coronária pode compensar e manter a perfusão coronária normal entre pressões sistólicas de 60 a 180 mmHg.
Através de alterações no diâmetro coronariano os barorreceptores promovem vasodilatação ou vasoconstrição, e o fluxo sanguíneo coronário é mantido em nível constante.
O fluxo nutriente é impedido durante a sístole, por causa da compressão extra-vascular das coronárias durante a sístole, ou seja, as pressões intracavitárias geradas dentro da parede ventricular esquerda ultrapassando a pressão intracoronária.
Consequentemente, pode resultar em reversão transitória na direção do fluxo sanguíneo para os vasos epicárdicos.Frequência cardíaca afeta o fluxo sanguíneo arterial coronariano:
1) A taquicardia causa restrição ao fluxo sanguíneo. Normalmente, vasodilatação coronariana compensa isso. O mecanismo da vasodilatação consta no aumento da atividade metabólica.
2) A bradicardia prolongando a diástole aumenta o fluxo coronariano e a liberação de nutrientes
C) Neurais e Neuro-humorais
Implicados os receptores:
A estimulação parassimpática tem apenas um ligeiro efeito vasodilatador sobre as artérias coronárias e não é um contribuinte significativo à regulação do fluxo sanguíneo coronariano normal.
Tanto a vasodilatação quanto vasoconstrição exercem papel menos importante do que os fatores metabólicos.
MECÂNICA DA FUNÇÃO DE BOMBA
As catecolaminas circulantes causam:
- contrações mais potentes (inotropismo)
- batimento cardíaco rápido (cronotropismo)
- relaxamento mais eficiente (lusitropismo)
A complacência ventricular: e diretamente dependente dos modificações no volume e na pressão. O ventrículo direito é mais complacente do que o ventrículo esquerdo.
II. DOENÇA ARTERIAL CORONARIANA
1. Patogenia
É uma doença progressiva que começa precocemente.mais susceptíveis são os vasos epicárdicos as artérias intramiocárdicas as menos.
A sucessão dos processos:
ruptura, degeneração e regeneração da membrana elástica interna depósito de mucopolissacarídeos proliferação de células endoteliais e de fibroblasto aparecem pequenos depósitos de material lipóide visíveis por debaixo da íntima formação de placas e a obstrução do lúmen arterial Estágio final da doença: os pacientes tornam-se sintomáticos ou morrem por:
2. Papel da Inflamação
A causa primária da doença arterial coronariana ateros-clerótica (DAC):
lesão endotelial
- resposta inflamatória da parede
- depósito de lipídios.
Uma resposta inflamatória está envolvida (todos os estágios).
Os monócitos:
expressam receptores de remoção de resíduos para as lipoproteínas modificadas, o que lhes permite ingerir lipídios. Estes lipídios modificados induzem a expressão de numerosas moléculas de adesão, quimocinas, citocinas pró-inflamatórias e outros mediadores da inflamação nos macrófagos e nas paredes cêlulares vasculares.
Os macrófagos ativados:
liberam mitógenos e quimioatrativos, como o fator estimulante das colónias de macrófagos, e a proteína-1 quimioatrativa dos monócitos.
Estas moléculas promovem e perpetuam a mobilização em andamento dos monócitos na placa em evolução.
Os sinais tissulares,estimulam as células T a elaborar citocinas inflamatórias, como o interferon-gamma e o fator de necrose tumoral beta, que estimulam ainda mais o processo inflamatório. Eles secretam enzimas proteolíticas que degradam o colágeno, o qual proporciona resistência ã capa fibrosa protetora da placa. Isto, por sua vez, torna a capa fina, fraca e com tendência à ruptura.
Os leucócitos ativados:
liberam os mediadores fibrinogênicos, que promovem a liberação pelas células locais de uma matriz extracelular densa. Além de promover o início do ateroma, a inflamação precipita a evolução das complicações trombóticas agudas.
3. Ruptura da Placa
70% a 80% dos trombos coronarianos ocorrem onde a capa fibrosa de uma placa aterosclerótica fissurou-se ou rompeu-se.
A extensão subsequente do trombo para dentro da placa, com a propagação do trombo corrente abaixo, acarreta evento coronariano agudo. De acordo com os paradigmas atuais, a ruptura da capa fibrosa leva à exposição de componentes trombogénicos da placa, com posterior ativação das plaquetas e das vias de coagulação que resultam na formação de trombos e em comprometimento luminar agudo
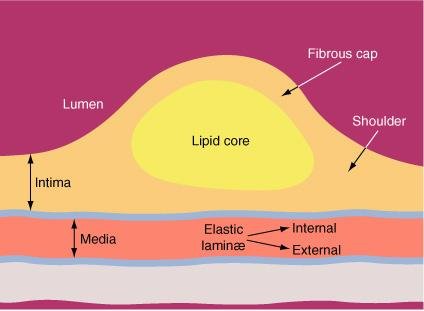
Anatomia de uma placa aterosclerótica. Após os leucócitos terem se acumulado nesta lesão, frequentemente morrem, algumas vezes por apoptose. que pode levar a um núcleo lipídico recoberto por uma capa fibrosa.
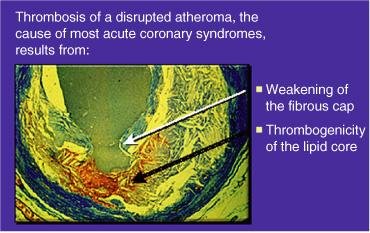
Trombose de um ateroma roto: enfraquecimento da capa fibrosa. A maioria das síndromes coronarianas é causada pela trombose de um ateroma roto, o que pode resultar do enfraquecimento da capa fibrosa e trombogenicidade aumentada do núcleo lipidico.
As características das placas vulneráveis ou de alto risco que apresentam tendência à ruptura são:
- um núcleo lipídico grande, excêntrico, macio;
- uma capa fibrosa fina;
- inflamação dentro da capa e da adventícia;
- neo-vascularidade da placa aumentada;
- evidências de remodelamento para fora ou positivo do vaso.
Capas fibrosas mais finas estão sob maior risco de ruptura. por causa do desequilíbrio entre a síntese e a degradação da matriz extracelular que resulta em redução global no colágeno e nos componentes da matriz:
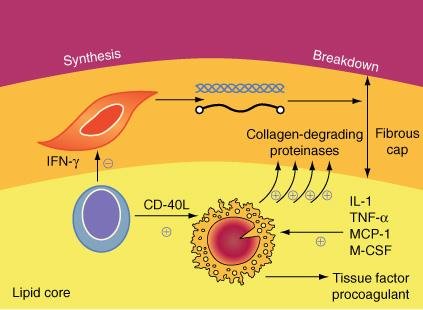
Metabolismo da matriz e integridade da capa fibrosa da placa. Esta figura apresenta a atual compreensão sobre a dinâmica da estabilidade da placa e a trombogenicidade. As células inflamatórias podem enviar mensagens moleculares para as células lisas musculares (interferon-gamma) que inibe a capacidade deste tipo celular de sintetizar colágeno novo para fortalecer a capa fibrosa da placa. Além disso, as células inflamatórias podem liberar enzimas proteolíticas capazes de degradar o colágeno e outros constituintes estruturalmente importantes da capa fibrosa da placa. Portanto, quando há inflamação na íntima, o colágeno responsável pela integridade da capa fibrosa da placa está sob um duplo ataque, sujeito tanto a uma redução na síntese quanto a um aumento na degradação. Isto arma o palco para a ruptura da placa. As células inflamatórias também são responsáveis pela sinalização e pela produção de quantidades crescentes de fator tissular, um potente pró-coagulante considerado responsável pela trombose das placas rotas
As metaloproteinases expressas pelas células inflamatórias dentro da placa realizam a degradação da matriz. A produção reduzida de matriz extracelular, provavelmente, também contribuiráno mesmo sentido.
Nem todas as rupturas da placa são sintomáticas embora a ruptura possa acarretar trombose. A trombogenicidade dos componentes da placa regula a resposta trombótica a ruptura da placa. Um dos mais potentes estímulos trombogénicos é o fator tissular, secretado pêlos macrófagos ativados, tanto da via intrínseca quanto da extrínseca. Ele pode ser encontrado em elevadas concentrações dentro do núcleo lipídico da placa.
Uma atividade física extrema, um estresse emocional intenso exposição a drogas exposição ao frio e infecções agudas podem causar ruptura como resultado de gatilhos específicos, mas ela tambem pode ocorrer espontaneamente.
4. Metabolismo Lipídico
A aterosclerose da artéria coronária está intimamente ligada ao metabolismo lipídico, especificamente ao do colesterol. A terapia com o inibidor da redutase da hidroximetilglutaril coenzima-A (estatina), tendo como objetivo reduzir os lipídios, resultou em redução significativa da mortalidade.
A terapia com estatina também modifica a composição lipídica dentro das placas pela redução na quantidade de lipoproteína-colesterol de baixa densidade (LDL) e pela estabilização da placa por vários mecanismos:
Portanto, pode estar indicado o emprego mais agressivo da estatina após operação de revascularização miocárdica (RVM).
5. Obstruções Coronarianas Fixas
Mais de 90% dos pacientes com doença cardíaca isquêmica sintomática apresentam aterosclerose avançada em decorrência de obstrução fixa.
As placas ateroscleróticas das artérias coronárias são:
No contexto da lei de Poiseuille, o volume de líquido homogéneo passando por unidade de tempo através de um tubo é diretamente proporcional ao seu comprimento e à sua viscosidade. As reduções no diâmetro luminar até 60% apresentam um impacto mínimo sobre o fluxo, e nenhum efeito clinico.
No entanto, uma vez que a área de corte transversal do vaso tenha diminuído em 75% ou mais, o fluxo sanguíneo coronário é significativamente comprometido. Clinicamente, isto não raro coincide com o início da angina de esforço. Com redução de 90% ou mais no diâmetro luminar, a resistência é 256 vezes maior do que na estenose de 60% e o fluxo coronariano pode ser inadequado em repouso.
ISQUEMIA E LESÃO DA CÉLULA MIOCÁRDICA
A isquemia miocárdica pode acarretar lesão reversível e/ou irreversível.
A isquemia de 15 a 20 minutos de duração está associada à disfunção miocárdica pós-isquêmica que dura horas a dias, apesar do restabelecimento do fluxo coronariano normal.
CONCEITO 1: Atordoamento miocárdico
Esta lesão reversível é denominada atordoamento miocárdico.
Os mecanismos subjacentes ao atordoamento são complexos, mas, em geral, parecem estar relacionados com:
A incidência de atordoamento miocárdico em pacientes no pós-operatório de RVM varia de 20% a 80%, dependendo de sua definição e/ou manifestação clínica.
Por exemplo, até 75% dos pacientes após a operação de RVM podem receber alguma forma de suporte inotrópico no período pós-operatório imediato para manter um índice cardíaco satisfatório, saturação venosa mista, pressão arterial e/ou débito urinário.
O atordoamento miocárdico pode resultar em redução mais profunda no débito cardíaco: no paciente com disfunção miocárdica pré-operatória grave ou com reserva cardíaca limitada. Neste caso, eles vão precisar de suporte inotrópico mais intenso e inserção de um balão intra-aórtico (BIA). A taxa de mortalidade secundária ao atordoamento pode chegar de 10% a 15%
No entanto, na maioria dos casos não está associado a prognósticos adversos específicos
CONCEITO 2: Miocárdio hibernante
Redução do fluxo sanguíneo coronariano em repouso com disfunção contrátil reversível
Após o restabelecimento do fluxo sanguíneo coronariano normal isto é reversível.
ATORDOAMENTO
Miocárdio disfuncional com fluxo sanguíneo normal, ou quase normal Miocárdio disfuncional com fluxo sanguíneo reduzido Anormalidade contrátil reversível com o passar do tempo
Anormalidade contrátil reversível com a reperfusão Ausência de danos irreversíveis
Ausência de danos irreversíveis
Cintilografla de perfusão (cintilografia com PET) normal ou aumentada
Cintilografia de perfusão (cintilografia com PET) aumentada Função contrátil diminuída
Função contrátil diminuída
Nenhuma piora metabólica durante a estimulação inotrópica
Recrutamento da reserva inotrópica à custa de uma recuperação metabólica
Ruptura da estrutura miofibrilar no modelo canino
Ruptura da estrutura miofibrilar no modelo canino
O coração não se adapta à subperfusão crónica
O coração não se adapta à subperfusão crónica
Não é obtido um estado estável entre a perfusão e a contração
Pode ser atingido estado estável entre a perfusão e a contração
Um não-pareamento perfusão-contração dura horas a dias até meses
Pareamento contração-perfusão pode ser mantido por períodos prolongados
Ausência de evidências para o processo de desdiferenciação em miócitos Evidências de um processo de desdiferenciação nos miócitos
CONCEITO 3: Infarto
representa morte e necrose celular, lesão irreversível resultante da isquemia que dura mais de 20 minutos e infarto trans-mural em 6 a 12 horas na ausência de um fluxo sanguíneo colateral adequado.
O risco de lesão e desigual. As células ao redor da periferia podem permanecer viáveis (as adjacentes a um sangue rico em oxigénio na câmara ventricular)
A morte celular leva, durante dias a:
Os miócitos são incapazes de regeneração - por fim, um tecido fibroso não-contrátil acaba substituindo os miócitos mortos
CONCEITO 4: Apoptose, ou a morte celular programada
A apoptose foi observada
São os mesmos mecanismos hipoteticos propostos para o atordoamento miocárdico, a hibernação e o infarto, isto é, a geração de ERO intracelular e/ou sobrecarga de cálcio intracelular. A morte apoptótica e morfológicamente e biologicamente diferente da morte celular secundária à necrose celular.
edema e a ruptura das membranas do sarcolema, mitocôndria e do núcleo a célula apoptótica encolhe agrupamento de cromatina nuclear o núcleo condensa e degrada em nucleossomas as células mortas são removidas através de um processo inflamatório as células são fagocitadas Nem todas as células apoptóticas estão comprometidas com morte celular nos estágios iniciais do processo
A apoptose representa um aspecto de um continuum da isquemia. A sua contribuição para a disfunção miocárdica após a isquemia pode ser mais relevante para o processo de remodelamento ventricular pós-isquêmico.
CONCEITO 5: Precondicionamento isquêmico (PCI)
Fenómeno isquêmico adaptativo no coração humano, constando redução no tamanho do infarto, com a apoptose e com as arritmias associadas à reperfusão.
O coração exposto a breves períodos de isquemia subletal, antes de um período de isquemia prolongada
Provavelmente a ativação de receptores na superfície celular e as vias de sinalização de transdução intracelular são os principais fatores desencadeadores do processo.
MANIFESTAÇÕES CLÍNICAS E DIAGNÓSTICO DA DOENÇA ARTERIAL CORONARIANA
.
1) Quadro Clínico
a) ANGINA PECTORIS:
Angina pectoris, um desconforto ou sensação de peso, aperto, compressão ou constricção no tórax.
FORMA INSTÁVEL
- dor em repouso
- dor com mínimos esforços
- dura mais do que 20 minutos.
- de natureza intensa
- início recente (no último mês)
- padrão em crescendo
A angina nem sempre está presente com a isquemia miocárdica. 15% dos pacientes com DAC significativa não se apresentam com angina a isquemia sendo detectada durante as monitorizações eletrocardiográfica (ECG) e/ou ecocardiográflca durante um teste de estresse.
Sistemas de classificação:
Classificação Funcional do New York Heart Association
Sistema de Classificação da Canadian Cardiovascular Society (CCS)
classe I são assintomáticos
classe II experimentam ligeira limitação das atividades habituais
classe III experimentam acentuada limitação da atividade com atividades físicas habituais
classe IV são incapazes de se submeterem a qualquer atividade sem desconforto
.
b) INFARTO MIOCARDICO contraste com a angina pectoris
dor torácica em esmagamento, mais
- náusea
- diaforese
- ansiedade
- dispneia
- tonteiras,
- fadiga
- vómitos
- dor irradiada para o pescoço e/ou mandíbula e ao longo do braço
Em resposta à duração e à gravidade da dor a frequência cardíaca e a pressão arterial se elevam.
Exame Físico
O exame físico pode ser pouco notável e a sintomatologia ser associada somente às manifestações da aterosclerose.
Quando a ausculta do tórax revela estertores, hepatomegalia, dolorimento no quadrante superior direito abdominal, ascite, edema periférico e pré-sacral acentuados provavelmente que a doença isquemica é mais avançada
Estudos Laboratoriais - O que pedir do laboratorio?
1. Perfil lipídico (colesterol, triglicerídeos, LDL, lipoproteína de alta densidade [HDL]) e talvez um nível de PCR-hs.
O nível de colesterol sérico elevado está associado a risco elevado de doença cardíaca coronariana (um aumento em 10% no colesterol sérico está associado à elevação de 20% a 30% na doença cardíaca).
As estatinas reduzem as doenças cardíacas coronarianas fatal e não-fatal.
ESTRATEGIA DE AVALIAÇÃO DOS PACIENTES COM SUSPEITA DE DOENÇA CORONARIANA
Marcadores da inflamação para predizer o desenvolvimento da doença cardíaca coronariana:
- PCR-hs: acrescenta valor preditivo do colesterol total e do colesterol HD, apesar de não ser conhecido ainda se estes marcadores podem ser empregados para melhor identificar os pacientes sob risco e alvo de intervenções terapêuticas
- molécula de adesão ICAM-1
- interleucina (IL>6 e o fator de necrose tumoral)
Estudos Diagnósticos
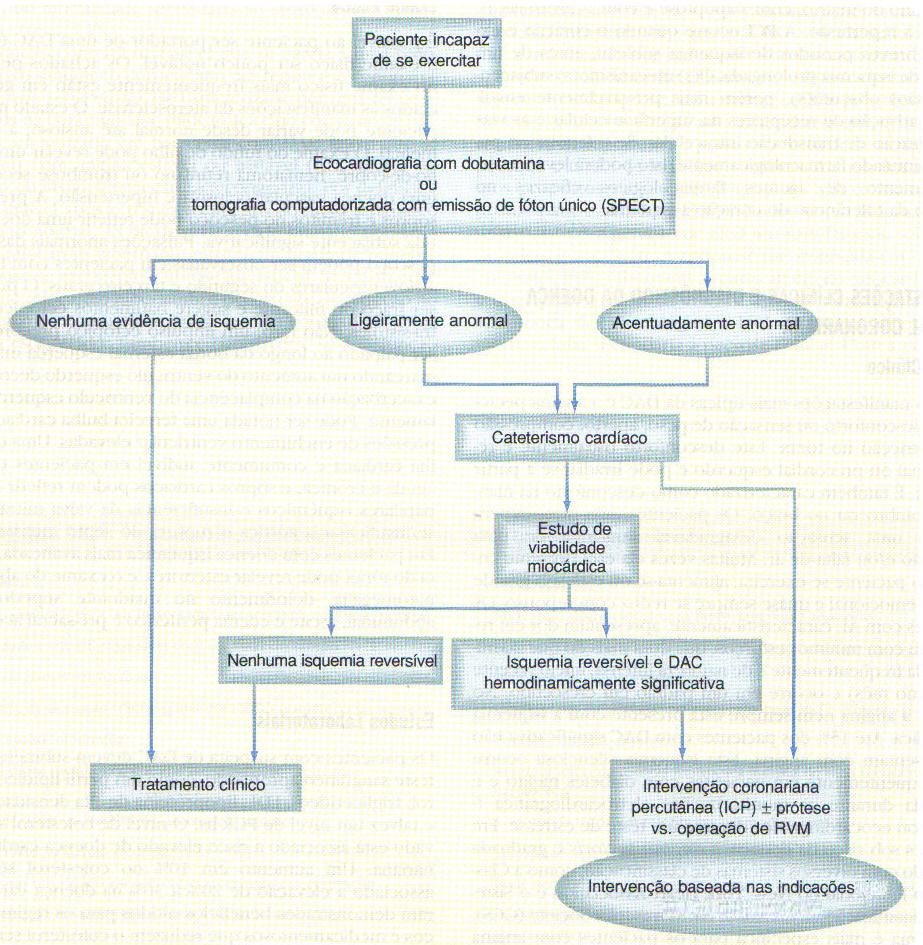
Há inúmeros métodos e tecnologias disponíveis para detectar a presença de estenose das artérias coronárias hemodinamicamente significativas e avaliar a função cardíaca e a viabilidade miocárdica. A informação, por fim, determina se um paciente deve ser tratado clinicamente, com uma angioplastia coronariana transluminar percutânea (ACTP), por uma intervenção coronariana percutânea (PCI) ou com uma operação de revascularização miocárdica. Muitos destes estudos poderão ser realizados mesmo se o paciente for incapaz de se exercitar.I. Radiografia de Tórax
identificar causa de desconforto ou dor torácica além da que se deve à DAC.Com uma DAC avançada, pode haver evidências de:
evidências presuntivas de aterosclero-se generalizada
Evidências de calcificações nas artérias coronárias,
Evidências de calcificações nas valvas aórtica ou mitral ou da aorta
II. Eletrocardiograma
INDICAÇÕES:
ECG SUSPEITO:
III. Ecocardiografia (de superfície e a transesofágica - ETE)
PRINCIPIO: usam ondas acústicas refletidas para realizar um imageamento
INDICAÇÕES
Pode revelar:
A administração de dobutamina intravenosa em doses incrementais intensifica a sensibilidade e a especificidade da ecocardiografia facilitando a diferenciação entre miocárdio atordoado, hibernante ou infartado.
Uma resposta inotrópica reduzida e evidências de novas anormalidades da motilidade parietal também são indicativas de isquemia miocárdica.
IV. Tomografia Computadorizada por Emissão de Fóton Único
(S. P. E. C. T. )
CARATERES:
INDICAÇÃO:
FORNECE DADOS SOBRE:
vasodilatadores (adenosina, dipiridamol)
inotrópicos (dobutamina)
V. Tomografia por Emissão de Pósitrons
(P. E. T. )
Técnica útil para
avaliação da viabilidade e metabolismo miocárdicos
avaliação do fluxo sanguíneo miocárdico
PRINCIPIO: a extração miocárdica de glicose está elevada nos miócitos ísquêmicos. O radiotraçador análogo da glicose F18-2-fluoro-2-deoxiglicose (FDG) utiliza-se para imagear o coração.
Na avaliação da viabilidade miocárdica, PET é superior ao SPECT com tálio, a perfusão com Tc99, e a ecocardiografia de estresse com dobutamina.
O valor preditivo positivo (VPP) e o valor preditivo negativo (VPN) chegam a 95%.
A perfusão dos traçadores não-metabólicos pelo miocárdio pode identificar dois padrões básicos:
perfusão normal/uniforme
miocárdio subperfúndido
em área de estenose arterial coronariana podemos delimitar o miocárdio viável utilizando uma combinação da perfusão anormal com um estudo PET.
-
após a revascularização miocárdica a melhora na motilidade parietal regional e na FE ventricular usa como fidedigno preditor o PET FDG.
As limitações ao PET incluem:
VI. Imagem de Ressonância Magnética com Gadolíneo
A perfusão do miocárdio de primeira passagem realizada com imagens de ressonância magnética (JRM) é uma boa alternativa, em virtude da:
A avaliação quantitativa da massa de infarto se correlaciona bem com o PET.
Comparada com a angiografla coronariana quantitativa, a IRM detectou lesões maiores que 50%, com especificidade e sensibilidade de 87% e 85%, respectivamente.op que comprova que a IRM cardíaca é um excelente método diagnóstico alternativo que pode ser usado para determinar a presença e a extensão da DAC e da viabilidade miocárdica
VII. Tomografia Computadorizada Espiralar com Multidetector Sincronizada por ECG/Tomografia Computadorizada com Feixes Eletrônicos
(T. C. F. E. )
a) instrumento em potencial para imageamento cardíaco
funcional
isquêmico
b) pode identificar
o afilamento parietal regional miocárdico
a presença de trombos murais
c) sensibilidade e especificidade globais de 90% e 80% na eficácia para as artérias coronárias específicas
Realçada pelo uso de contraste, TC por feixe de elétrons (TCFE) detecta lesões hemodinamicamente significativas. A quantificação pela TCFE do cálcio na artéria coronária prediz achados SPECT anormais e se correlaciona com uma isquemia miocárdica assintomática.
Isto sugere que a TCFE pode ser um bom teste de rastreamento para DAC.
VIII. Cateterismo Cardíaco
Avalia a anatomia:
A identificação da DAC e avaliação da sua extensão e gravidade precisa de angiografla coronariana de alta qualidade.
O cateterismo cardíaco que inclua um ventriculograma também permite a avaliação das funções sistólica e diastólica, o diagnóstico de derivações intracardíacas, a diferenciação entre restrição miocárdica da constrição pericárdica e avaliação da disfunção valvar. O cateterismo cardíaco direito é usado para medir as pressões venosa central, atrial direita, ventricular direita e da artéria pulmonar e as pressões encunhadas pulmonares, bem como o débito cardíaco. Também pode ser usado para avaliar a presença de derivações intracardíacas, avaliar arritmias e iniciar um ritmo cardíaco temporário.
MODALIDADES DE DETEÇÃO DA DOENÇA ARTERIAL CORONARIANA E AVALIAÇÃO DO PROGNÓSTICO
- baixo custo;
- duração curta;
- avaliação do estado funcional;
- alta sensibilidade na doença trivascular ou na lesão do tronco da coronária esquerda;
- prognóstico (p. ex., isquemia a baixas cargas de trabalho)
- Sensibilidade subótima;
- baixa taxa de detecção na doença univascular;
- se o ECG basal for anormal, não e possivel fazer algum diagnostico;
- baixa especificidade nas mulheres pré-menopausa;
- precisa obter > 85% da frequência cardíaca máxima para acurácia
Cintilografia de Perfusão com Exercício/ Estresse/Farmaco-
lógico
- avaliação simultânea da perfusão e da função (SPECT sincronizado pelo ECG);
- maior sensibilidade e especificidade do que o teste ergométrico;
- elevada especificidade com o Tc99;
- pode ser realizado na maior parte dos pacientes;
- valor prognóstico adicional;
- acurácia comparável com o estresse farmacológico;
- viabilidade e isquemia simultaneamente avaliadas;
- análise quantitativa das imagens
- especificidade subótima com Tl201;
- tempo de procedimento longo com Tc99;
- maior custo do que o teste ergométrico;
- exposição à radiação;
- imagens de má qualidade em obesos
- maiores sensibilidade e especificidade do que o teste ergométrico;
- valor prognóstico adicional;
- valor comparável ao estresse com a dobutamina;
- tempo de exame curto;
- identificação das anormalidades cardIacas estruturais;
- avaliação simultânea da perfusão com os agentes de contraste;
- custo relativamente menor;
- nenhuma radiação
- sensibilidade diminuída para a detecção da doença univascular ou da estenose leve com a imagem pós-exercício;
- incapacidade de realizar imagens de todo o ventrículo esquerdo em alguns pacientes;
- altamente dependente do operador;
- nenhuma análise quantitativa das imagens;
- alguns pacientes com péssima janela acústica (p. ex., doença pulmonar obstrutiva crónica);
- isquemia da zona de infarto menos bem detectada
AVALIAÇÃO DA VIABILIDADE MIOCÁRDICA
- alta sensibilidade para predizer a melhora funcional após a revascularização;
- critérios quantitativos objetivos (p. ex., > 60% de captação no segmento);
- FEVE quantificada na Cintilografia com Tc99m-sestamibi ou Tc99 m-tetrofosmin; preditiva de prognósticos clínicos
- comparada ao PET, resolução e sensibilidade diminuídas;
- menos quantitativa do que o PET; áreas de atenuação (p. ex., parede inferior com as cintilografias com Tc99m-sestamibi) interpretadas erroneamente como não-viáveis;
- não pode diferenciar a viabilidade endocárdica da epicárdica;
- nenhuma medida absoluta do fluxo sanguíneo;
- menor especificidade do que a ecocardiografia com dobutamina para predizer a melhora funcional após a revascularização
- avaliação simultânea da perfusão e do metabolismo;
- maior sensibilidade do que qualquer outra técnica;
- boa especificidade;
- nenhum problema de atenuação;
- o fluxo sanguíneo absoluto pode ser medido;
- preditivo dos resultados
- menor especificidade do que a ecocardiografia com dobutamina ou a IRM;
- não consegue separar a viabilidade endocárdica da epicárdica;
- alto custo e tecnologia extremamente sofisticada;
- disponibilidade limitada
- maior especificidade do que as técnicas nucleares;
- a viabilidade é avaliada em baixas doses e a isquemia em doses maiores;
- avaliação da regurgitação mitral na ecocardiografia basal;
- preditiva de resultados;
- amplamente disponível;
- menor custo do que a IRM com dobutamina
- péssimas janelas em 30% dos pacientes;
- menor sensibilidade do que as técnicas nucleares;
- miocárdio com baixo fluxo pode não se mostrar aumentado durante a estimulação;
- confia na avaliação visual do espessamento parietal
- integridade miocirculatória avaliada assim como o espessamento sistólico;
- melhor estimativa da extensão da viabilidade do que apenas a avaliação funcional;
- delineação precisa da área de necrose;
- resolução da perfusão endocárdica vs. epicárdica;
- viabilidade avaliada na presença de oclusão coronariana total
- janelas difíceis em 30% dos pacientes;
- problemas de atenuação;
- escassos dados clínicos disponíveis
- avalia a reserva inotrópica no endocárdio com um marcador;
- medida da espessura parietal mais precisa do que com a ETE (ecografia transesofagica);
- melhor qualidade de imagem do que a ecocardiografia para a reserva contrátil;
- avaliação simultânea da perfusão utilizando-se um realce com contraste;
- boa sensibilidade e especificidade para a viabilidade
- maior custo do que a da ecocardiografia;
- disponibilidade limitada;
- menor sensibilidade do que as técnicas nucleares, porém pode ser mais específica; a informação das imagens não está disponível em tempo real;
- os pacientes com marcapassos ou cardioversores-desfibriladores implantáveis não podem realizar o exame
CIRURGIA DE REVASCULARIZAÇÃO MIOCÁRDICA: ASPECTOS TÉCNICOS
I) O CONCEITO DE DERIVAÇÃO CARDIOPULMONAR
Os componentes básicos de uma bomba cardíaca extracorpórea consistem em:
A máquina para derivação cardiopulmonar (BCP)
> Construída a partir de vários materiais biocompatíveis:
- policarbonato
- cloreto de polivinilo
- polietileno
- aço inoxidável
- teflon
- titânio
- borracha de silicone
- poliuretano
>> tem múltiplos portais ou acessos para:
- amostras de sangue
- estudos laboratoriais
- infusão de sangue
- produtos de sangue
- cristalóides e/ou drogas
>>> condutos de sangue projetados para minimizar:
- a turbulência
- a cavitação
- as alterações na velocidade do fluxo sanguíneo
2 L de solução são necessários para se fazer uma primeira lavagem na bomba cardíaca em adultos
e uma solução salina balanceada e, frequentemente, uma solução com amido
>>>> componentes suplementares
a) sistema de sucção para cardiotomia:
- coleta o sangue não-diluído ou "limpo" a partir das câmaras cardíacas abertas e do campo cirúrgico
- filtra, desaera e retorna esse sangue nà bomba de derivação
b) um dispositivo de um sistema em separado,
- coleta aquele sangue diluído do campo cirúrgico e o sangue que foi exposto a elementos potencialmente prejudiciais (p. ex., citocinas, gordura)
- concentra as hemácias lavadas antes de retorná-las diretamente para o paciente
c) dispositivo para a infusão de cardioplegia, utilizado para administrar sangue frio enriquecido de potássio ou soluções de cristalóides na circulação coronariana, consiste em:
- uma bomba em separado,
- um reservatório
- um trocador de calor
O papel dele e proteger o coração durante a parada isquêmica
>>>>> medidas suplementares:
1) Se o paciente estiver anêmico (hematócrito < 25 mL/dL), o sangue homólogo pode ser acrescentado
2) E preciso de supressão da cascata de coagulação pela heparina (os componentes da bomba de derivação e a ferida cirúrgica são poderosos estimulantes para a formação de trombos).
CUIDADO !!!!!!! a heparinização sistémica pode resultar em perda maior de sangue e necessidade de transfusões de sangue homólogo e de produtos do sangue. A heparina também pode induzir hipotensão transitória como resultado de uma reação alérgica.
3) consumo de oxigénio: vai ser estabelecido, em media, em média, 80 a 125 mL/min/m2, similar ao do adulto anestesiado sem derivação
4) Garantir uma pressão arterial de pelo menos 50-70 mm Hg. Ela tem que ser com 10-15 mm Hg mais alta quando se sabe que o paciente tem doença arterial obstrutiva intracraniana ou carotídea.
5) Durante a BCP, a pressão sanguínea sistémica é mantida pelo:
ajuste da velocidade da bomba rolante, manipulando-se o volume intravascular do paciente e
ajuste da resistência vascular periférica pela infusão de vasodilatadores como o nitroprussiato ou nitroglicerina ou vásoconstritores como e efedrina
>>>>>> Parámetros de funcionamento
O consumo médio de oxigénio do corpo reduz-se em 50%
para cada 10° C de diminuição na temperatura corporal.Abaixo de 28° C, uma velocidade de fluxo de 1,6 L/min/m2 pode ser segura por até 2 horas.
Desvantagens significativas do emprego de uma hipotermia significativa para acomodar velocidades de fluxo mais lentas incluem:
Estas últimas podem resultar em maior propensão ao sangramento uma vez que o paciente esteja sendo reaquecido.
II) O CONCEITO DE PROTEÇÃO MIOCARDICA
Técnicas de Proteção Miocárdica
Graus variáveis de lesão miocárdica e de necrose podem causar morte em insuficiência cardíaca ou períodos de baixo débito cardíaco em alguns pacientes (apesar da revascularização miocárdica adequada!) como resultado de:
- dano isquêmico sofrido durante o momento do clampeamento transverso da aorta
- parada isquêmica
Após a colocação do clampe transversal aórtico resulta em parada diastólica do coração, acentuada redução no consumo miocárdico de oxigénio e campo cirúrgico limpo e essencialmente obrigatorio:
- o uso da hipotermia sistémica
- a infusão de cristalóide hiperpotassêmico frio
- soluções sanguíneas diretamente na aorta ascendente
Técnicas de administração de soluções cardioplégicas
Usam-se varias:
Na abordagem balanceada; isto é, a solução cardioplégica é administrada primeiramente, anterogradamente, pela aorta ascendente proximal e, então, retrogradamente por um cateter no seio coronário inserido através de uma sutura em bolsa colocada no átrio direito.
A distribuição da cardioplegia e relativamente homogénea isto sendo favorecido pelo:
- extensa colateralização entre as veias e as artérias coronárias
- a escassez de valvas dentro do sistema venoso coronariano
Doses adicionais quase sempre são administradas a cada 15 a 20 minutos. A temperatura do miocárdio pode ser continuamente monitorizada com sonda intracardíaca.
III. Enxertos de Derivação Arterial Coronariana
1) Os condutos preferidos: as artérias torácicas internas (ATIs) (esquerda e/ou direita), a esquerda sendo geralmente usada como enxerto para DAE. O pedículo da ATI direita pode ser usado como enxerto para a ACD; se ela tiver um comprimento suficiente, poderá ser usada como enxerto na ADP ou ramos da CxE.
Riscos em potencial: os pacientes diabéticos podem estar sob risco aumentado de infecções a mobilização bilateral das ATIs foi associada a um risco 14 vezes maior de infecções da ferida esternal2) Para os demais vasos remanescentes a cirurgia cardiovascular usa os segmentos de veias safenas invertidos.
3) A artéria radial frequentemente é empregada em conjunto com enxertos ATI para revascularizar o coração existindo evidências da existência de um benefício na sobrevida com essa opção. Também apresenta vantagens adicionais, eliminando a necessidade de incisões nas extremidades e o risco de infecções nas feridas cirúrgicas das pernas.
O teste de ALLEN e obrigatorio: o arco palmar é avaliado com ultra-sonografia para confirmar a presença de circulação colateral adequada na mão. é procurada a artéria radial, usando-se a técnica sem toque. A nitroglicerina e utilizada durante a dissecção para minimizar o vasoespasmo. O enxerto livre, então, é armazenado em solução que contenha heparina e papaverina.
4) Outro conduto arterial pediculado que pode ser empregado é a artéria gastroepiplóica. Este conduto é mais apropriado para os vasos nas porções inferior e lateral do ventrículo esquerdo. As limitações associadas ao emprego deste enxerto incluem sua predileção para o vasoespasmo, torções, dobras e vulnerabilidade a erros técnicos no sítio anastomótico devido à sua fina parede arterial. Em geral, a artéria gastroepiplóica é reservada para os pacientes com opções limitadas para condutos.
5) O conduto mais comumente empregado é a veia safena interna. O conduto venoso é armazenado em solução salina heparinizada ou em sangue até que seja necessário
A escolha da perna direita ou esquerda depende de:
- evidências de retiradas prévias de veias safenas
- doença de estase venosa
- insuficiência vascular arterial
- presença de ferimentos não-cicatrizados,
- veias varicosas
- história de tromboflebite superficial
Utilizando-se o ultra-som Doppler pode ser avaliada a adequação da veia no pré-operatório
Técnicas empregadas para procurar a veia safena :
- incisão longa e única sobre a veia
- múltiplas pequenas incisões com pontes de pele intactas
- dissecções endoscópicas:
- minimiza a extensão da incisão cutânea
- menores taxas de infecção
- menos dor pósoperatória
- minimiza o estiramento ou a manipulação do vaso
- evita lesão endotelial e tromboseA veia safena ideal:
Se a veia safena for inadequada ou estiver indisponível, a veia safena externa poderá ser utilizada.
- diâmetro de 3,5 mm
- nenhuma varicosidade
- nenhuma área de estreitamento
Fechar em camadas as incisões nas pernas, para eliminar o espaço morto e evitar a formação de hematomas.
IV. Anestesia para a Revascularização Miocárdica
A) A ANESTESIA BALANCEADA
A anestesia com altas doses de narcóticos, rotineiramente empregada uma década atrás, evoluiu para um método de anestesia balanceada.
Isso presume uso criterioso de: narcóticos de ação mais curta (remifentanil, por exemplo) suplementado por agentes voláteis mais seguros, como o sevoflurano e/ou agentes intravenosos de ação curta, como o.
Narcóticos de ação mais curta (remifentanil, propofol) tem como beneficio:
- menor tempo de suporte ventilatório,
- menor tempo de estadia na unidade de terapia intensiva (UTT)
- redução na duração da estadia hospitalar.
B) TECNICAS SUPLEMENTARES
Também houve maior emprego de técnicas suplementares, como:
O ETE também pode ser usado para determinar a presença de ar intracavitário e da resposta ventricular ao crescente volume intravascular. Esta informação pode ser útil para a decisão do melhor momento para o desmame do paciente da BCP.
V) OPERAÇÃO
A preparação para a operação de RMV inclui:
a) a administração de antibióticos pré-operatórios:
cefuroxima 1,5 g intravenosa pelo menos 30 minutos antes de se realizar a incisão cutânea.
vancomicina 1 g intravenosa para um paciente com alergia à penicilina pelo menos 30 minutos antes de se realizar a incisão cutânea.
b) colocação apropriada das linhas de monitorização hemodinâmica e a inserção de um cateter de Foley,
c) o paciente é posicionado na posição de pernas de rã e recebe um acolchoamento apropriado para minimizar os pontos de pressão.
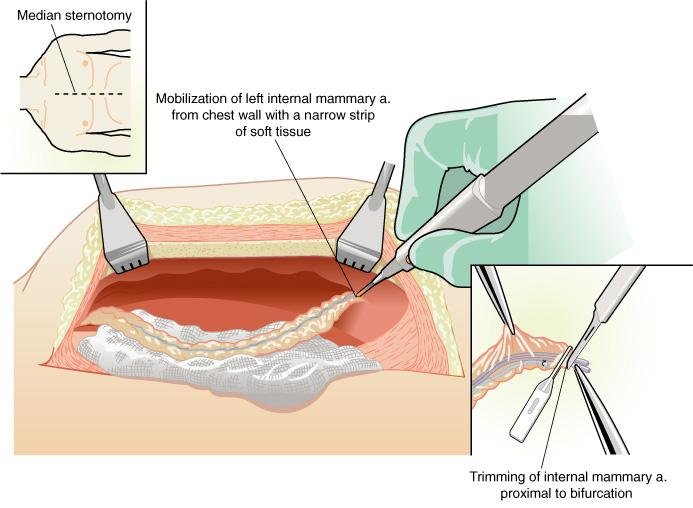
d) O paciente é preparado e envolto em campos cirúrgicos e realiza-se uma incisão de esternotomia mediana
CIRURGIA PROPRIO-DITA
A) A FASE DA MAMARIA
1) afastar e elevar a metade esquerda do esterno e expor a ATI, identificando e verificando a pulsatilidade da arteria
2) abrir a fascia endotorácica medialmente da artéria.
ATENÇÃO! Uma tração mínima e uma técnica sem toques são empregados para proteção do vaso. O uso de uma luz direta e a magnificação proporcionadas por lupas cirúrgicas permitem a dissecção precisa
3) mobilizar o pedículo e identificar a artéria e os ramos venosos com ajuda de dispositivo de radiofreqüência ou um eletrocautério.
A vantagem do dispositivo de radiofreqüência é a ausência de energia térmica transmitida com o seu risco associado de lesão vascular induzida pelo calor.
4) os ramos laterais são clipados no lado arterial e o outro lado é clipado ou cauterizado.
5) O pedículo é mobilizado a partir da artéria e da veia subclávias por baixo do manúbrio até a bifurcação dos ramos epigástricos superiores e musculo-frênicos, distalmente ao nível do diafragma.
6) anticoagulação com heparina
7) ATI é seccionada na bifurcação distai e mede-se o seu fluxo.
Um fluxo livre maior do que 60 mL/min é o desejável.
8) o vaso é suavemente ocluído distalmente com um clampe, e o pedículo é inoculado com jato de solução de papaverina para promover dilatação arterial e prevenir o espasmo vascular.
9) a extremidade distai do vaso é preparada para o enxertamento neste momento, ou isto é adiado até antes da realização da anastomose.
Se o diâmetro da ATI parecer adequado, mas o vaso não possuir um influxo ou uma pulsatilidade adequadas, o pedículo poderá ser utilizado como enxerto livre. Neste caso, o pedículo é seccionado ao nível da artéria subclávia e armazenado em uma solução de papaverina até quando for necessário. Outra equipe cirúrgica pode procurar a veia safena interna, ou a artéria radial, simultaneamente.
B) A FASE AORTICA
10) o paciente é heparinizado sistemicamente (300 unidades/kg), garantindo um tempo de coagulação ativado alvo (TCA) maior do que 400 segundos.
11) examinar a aorta para detectar áreas de calcificação e determinar o local da canulação e do clampeamento
A ecocardiografla epiaórtica pode ser usada para identificar placas calcificadas e ajuda a planejar o local da canulação a fim de minimizar a ruptura das placas ateroscleróticas e reduzir o risco de em-bolização e de acidente vascular cerebral (AVC).
12) proximalmente à artéria inominada é canulada a aorta ascendente utilizando-se suturas duplas em bolsa com torniquetes de Rumel (ancoradas ao lado da cânula)
A extremidade aberta da cânula é irrigada retrogradamente para remover o ar e qualquer resto aterosclerótico nesta que, então, é ancorada à linha de perfusão arterial da máquina de BCP.
13) ancorar a extremidade proximal da cânula aórtica nas bordas da ferida cirúrgica
14) introduz-se uma cânula dentro do átrio direito através de uma única sutura em bolsa na auriculeta direita (canulação venosa)
Quando se utiliza uma drenagem venosa em estágio duplo, a ponta é direcionada para dentro da veia cava inferior
15) apertar as suturas venosas em bolsa utilizando-se um torniquete de Rumel, ancorando-lhes à cânula venosa. A extremidade aberta é colocada como uma interface com a tubulação venosa da bomba de derivação. Se é administrada cardioplegia retrógrada, coloca-se uma sutura em bolsa próxima ao sulco AV, o átrio é incisado e introduz-se uma cânula de cardioplegia retrógrada no seio coronário.
16) o paciente é colocado em BCP e resfriado até uma temperatura central de 30 a 32° C
17) Durante o resfriamento, pode ser inserida uma cânula cardioplégica na aorta através de uma sutura em bolsa em separado.
Ela será suficientemente distanciada da cânula aórtica para permitir espaço para a aorta ser clampeada transversalmente. Além de servir para infundir as soluções cardioplégicas, a cânula pode ser usada para descomprimir o ventrículo esquerdo.
18) Uma vez obtidos fluxos de bomba aceitáveis (2,2 L/min/m2) e pressão média do sangue estabilizada (50 a 70 mmHg), a aorta é clampeada transversalmente e infunde-se uma solução cardioplégica fria.
O coração também é resfriado topicamente usando-se uma solução salina fria. O nervo frênico pode ser protegido cobrindo-o com uma compressa isolante. Se forem empregadas as cardioplegias anterógrada e retrógrada, dois terços da solução serão administrados anterogradamente, com o restante oferecido através da cânula retrógrada.
19) A cardioplegia com sangue oxigenado anterógrada e/ou retrógrada então é administrada intermitentemente, geralmente a intervalos de 15 a 20 minutos, para que seja assegurada uma proteção miocárdica adequada durante o período de parada isquêmica.
C) ANASTOMOSES DISTAIS
Os vasos-alvo podem ser identificados e os locais de anastomoses distais determinados antes do clampeamento transversal da aorta ou posteriormente.
A vantagem da primeira é que as artérias coronárias estão distendidas e é mais fácil a avaliação do comprimento apropriado do enxerto.
O local ideal para a anastomose deve ser:
facilmente acessível
livre de doença aterosclerótica
ter um diâmetro de pelo menos 1,5 mm.
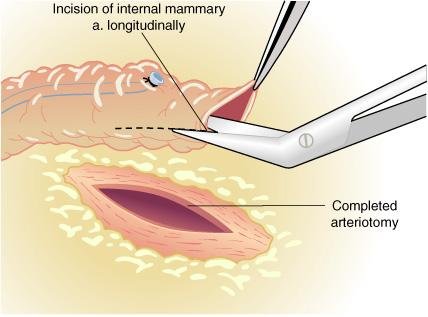
Ja o lugar da anastomose sendo selecionado:
a) para expor o aspecto anterior da artéria coronária usa-se uma lâmina Beaver
b) um pequeno bisturi de ponta afiada é usado para puncionar o vaso;
c) a arteriotomia é então estendida usando-se tesouras finas de coronária para criar uma abertura de 3 a 7 mm medida para se parear ao diâmetro luminar do conduinte.
Deve-se tomar cuidado em não lesar a parede posterior. Evita-se endarterectomia da artéria coronária, se possível, pois isto está associado a uma maior taxa de trombose do enxerto/artéria nativa.
d) quando se emprega um segmento de veia safena invertida
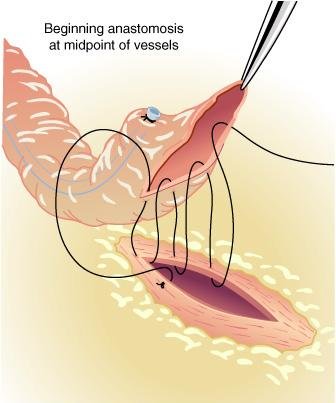
Quando se emprega a ATI, a extremidade distai do vaso é biselada em um ângulo agudo e então a incisão é estendida usando-se as tesouras finas para íris
A arteriotomia do vaso nativo é medida para se parear com a abertura da ATI. A anastomose término-lateral pode ser completada usando-se uma sutura contínua de polipropileno 8-0.
Ao ser completada a anastomose, ambos os lados do pedículo são suturados ao epicárdio para minimizar a tensão sobre a anastomose e/ou torcer o enxerto quando o paciente é desmamado da BCP e os pulmões são ventilados.
D) ANASTOMOSES PROXIMAIS
Se as anastomoses proximais forem completadas após as anastomoses distais terem sido completadas, isto poderá ser realizado enquanto o clampeamento transversal da aorta ainda está no seu local ou após ele ter sido removido e substituído por um clampe de oclusão parcial. Este último permite ao coração ser perfundido e reaquecido.
VI) Término da Derivação Cardiopulmonar
Após ser completada a última anastomosegeralmente é iniciado o reaquecimento sistémico.
É evacuado e reprocessado o sangue que se acumulou nos espaços pleurais. Por isso, utiliza-se um cell saver para reinfusão subsequente.
Após a remoção do clampeamento transversal da aorta, o coração quase sempre começa a bater espontaneamente, em pouco tempo. Apesar de poder desenvolver-se um ritmo sinusal normal, ele frequentemente entra em flbrilação ventricular e requer cardioversão usando-se pás de desfibrilador interno.
SITUAÇÕES:
1) frequência cardíaca for menor do 70 batimentos/minuto:
colocar cabos temporários de marcapassos atriais e ventriculares na superfície do coração, em geral no átrio direito ou no ventrículo direito, e
inicia-se o estímulo com o marcapasso a aproximadamente 90 batimentos/minuto
2) Se o paciente tenha sido adequadamente reaquecido (36,5° C), o ritmo sinusal normal foi reiniciado e a ventilação restabelecida, então
o paciente é desmamado da BCP pela gradual redução nas velocidades de fluxo de bomba para zero enquanto se mantém um volume intravascular adequado via transfusão.
3) Se for necessário manipular o estado contrátil do coração e a resistência vascular periférica (pós-carga):
infusão de agentes inotrópicos como a dobutamina
vasodilatadores como a nitroglicerina
vasoconstritores a efedrina
4) Se o paciente tenha se estabilizado fora da BCP,
A pele pode ser aproximada com uma sutura contínua com um fio subcuticular monofilamentar e Steri-strips ou grampos.
VII. Cuidados Pós-operatóríos
A) CUIDADOS IMEDIATOS:
1) transporte do paciente para a UTI de cirurgia cardíaca
2) realizar um exame físico direto na chegada. Isto inclui a:
- avaliação do nível de consciência
- ruídos respiratórios
- pulsos periféricos
- temperatura corporal.
3) drenagem através de um tubo mediastínico deve ser registrada e avaliada a cada hora.
4) ajustes iniciais do respirador devem ser feitos para serem pareados aos da sala de operação. Alternativamente, o respirador pode ser ajustado a um volume corrente de 12 ml/kg, uma frequência respiratória mandatória intermitente de 8 a 10 respirações/minuto, uma fração de oxigénio inspirado de 60% e uma pressão positiva ao final da expiração (PEEP) de 5 cm H2O para proporcionar uma margem de segurança adequada.
5) É obtida uma radiografia portátil de tórax para confirmar a posição do tubo endotraqueal e identificar pneumotórax, atelectasias, edema pulmonar ou derrames pleurais.
6) Os estudos laboratoriais iniciais devem incluir:
7) No que diz respeito aos dispositivos de monitorização contínua, o paciente deve realizar:
Em pacientes selecionados, as pressões da artéria pulmonar e o débito cardíaco são monitorizados continuamente usando-se um cateter de Swan-Ganz.
Objetivos:
OBJETIVO CAUSA EFEITOS COMBATER evitar acentuadas elevações na pressão arterial (pressão arterial média > 100 mmHg)
hipoxemia, hipercarbia, hipotermia com tremores e sedação inadequada e analgesia pódem ser causa de hipertensão
Hipertensão significativa resulta em aumento no consumo miocárdico de oxigénio e tensão sobre os cateteres arteriais e redução no índice cardíaco, especialmente nos pacientes com significativa disfunção ventricular esquerda preexistente
impeza das secreções retidas no tubo endotra-queal, ajuste dos controles do respirador, aquecimento do paciente com cobertores de ar quente, administração de analgésicos e infusão de vasodilatadores
manutenção de um índice cardíaco de 2,2 L/min/m2 e uma oxigenação venosa mista de 60% isquemia miocárdica (alterações assintomáticas do segmento ST até o infarto com uma hipotensão profunda) espasmo arterial coronariano, hipoperfusão da ATI ou oclusão precoce do enxerto hipovolemia, frequência/ritmo cardíaco anormal, disfunção miocárdica e tamponamento cardíaco débito cardíaco baixo após a BCP
O espasmo arterial coronariano pode ser tratado com nitroglicerina intravenosa ou bloqueadores do canal de cálcio
usar um cateter de Swan-Ganz para avaliar a adequação da perfusão sistémica, medindo-se o índice cardíaco e monitorizando-se a oxigenação venosa mista
soluções de Ringer-lactato são apropriadas, mas podem ser suplementadas com até 1,5 L de amido hidro-xi-etil (Hetastarch) ou produtos de sangue.
angiografia coronariana de emergência, ou re-operação e/ou reenxerto
ritmo desejável: sinusal
frequência entre 70 e 80 batimentos/minuto
pós-operator, a maioria dos pacientes encontra-se taquicárdica
se tiverem sido tratados previamente à operação com beta-bloqueadores, podem estar bradicárdicos< 60 batimentos/minuto
anormalidades eletrolíticas, acidose, níveis elevados de cate-colaminas circulantes e isquemia miocárdica
Um ritmo sinusal normal assegura sincronismo AV e manutenção de uma contração atrial, o que pode contribuir para até 25% do débito cardíaco
Se o paciente estiver bradicárdico ou apresentar evidências de bloqueio atrioventricular, deverá ser iniciado um marcapasso atrial ou AV
As taquiarritmias supraventriculares associadas a uma instabilidade hemodinâmica devem ser tratadas imediatamente com cardioversão
Os pacientes hemodinamicamente estáveis com taquicardia supraventricular recidivante devem ser tratados com adenosina em doses crescentes.
O flutter atrial pode ser tratado utilizando-se o marcapasso acelerado.
A fibrilação atrial responde à digoxina, procainamida, diltiazem, beta-bloqueadores ou amiodarona intravenosos e à cardioversão. O paciente hemodinamicamente instável com arritmias ventri-culares precisa de uma desfibrilação imediata e uma infusão em bolo intravenosa de lidocaína seguida por uma infusão contínua. Outros agentes alternativos incluem a procainamida e o bretílio.
B) AS PRIMEIRAS 12 HORAS POS-OPERATORIO:
As considerações iniciais devem ser:
- a manutenção de uma pressão arterial adequada,
- a manutenção de débito cardíaco,
- da correção de distúrbios da coagulação,
- correção da hipocalcemia ionizada,
- estabilização do volume intravascular
- normalização da resistência vascular periférica via administração de:
- soluções cristalóides,
- sangue ou produtos do sangue
- agentes inotrópicos
- cálcio
- vasodilatadores e/ou vasoconstrictores.
A disfunção miocárdica também é comum em pacientes após BCP e pode ser secundária ao atordoamento miocárdico (uma lesão transitoriamente reversível) ou à necrose miocárdica (infarto).
Nestes pacientes, se a frequência cardíaca, a précarga ventricular, o ritmo e a pós-carga ventriculares foram otimizados e eles ainda demonstrarem um baixo débito cardíaco, eles mais provavelmente irão se beneficiar de um suporte inotrópico.
- epinefrina,
- norepinefrina,
- dobutamina
- dopamina
1. A epinefrina é uma droga eficaz pelas suas propriedades alfa-adrenérgicas:
2. A norepinefrina
3. A dobutamina e a dopamina apresentam efeitos comparáveis sobre o débito cardíaco:
4. A milrinone
é um inibidor da fosfodiesterase (lentifica a degradação do monofosfato cíclico de adenosina (AMPc).
O seu mecanismo de ação complementa o das catecolaminas, que estimulam o AMPc.
é usada em combinação com outros agentes inotrópicos para obter um resultado sinérgico.
C. Balão de Contrapulsação Intra-aórtíco (BIA)
Indicação de terapia farmacológica intensiva com o BIA:
pacientes que demonstram uma profunda disfunção miocárdica
não respondem à reposição volumétrica,
VANTAGENS:
Se o BIA foi empregado para controlar a dor torácica no pré-operatório, ele frequentemente é removido em 24 horas após a operação. No entanto, se ele foi usado no pré-operatório para instabilidade hemodinâmica, o desmame do BIA pode ser mais difícil e precisar de mais tempo.
D. TAMPONAMENTO
No período pós-operatório, o tamponamento cardíaco pode ser devido à formação de um coágulo pericárdico e à compressão cardíaca. A condição deverá ser suspeitada se o paciente:
O diagnóstico pode ser feito com base em:
sinais de alargamento do mediastino na radiografia de tórax
evidências de derrame pericárdico pela ecocardiografia.
INVESTIGAÇÕES:
Uma vez feito o diagnóstico, o paciente deve retornar à sala de operação para a evacuação do coágulo e alívio da compressão.
Se as condições do paciente estiverem piorando rapidamente poderá ser realizada uma abordagem subxifóide simples à beira do leito, o que resulta em melhora dramática na hemodinâmica.E. SANGRAMENTO POS-OPERATORIO
Apresenta risco aumentado de sangramento após a operação de RVM: a combinação de heparinização, hipotermia, BCP e reversão com a protamina
Está associado a um aumento significativo na morbidade e na mortalidade se precisar de transfusão e/ou reoperação para interromper o sangramento.
O sangramento e razão de exploração do mediastino se for:
As fontes típicas de sangramento cirúrgico:
na maior parte das vezes, não se identifica um local específico de sangramento (somente 20% deles são descobertos) e ele está relacionado com:
ATITUDE TERAPEUTICA:
A) suspeita de sangramento pós-operatório não-cirúrgico, :
B) administra hemácias se o paciente estiver sangrando ativamente e/ou estiver anêmico (hematócrito < 25%)
C) administra plaquetas se houver evidência de:
trombocitopenia (< 50.000/mm3)
disfunção plaquetária (tromboelastografla anormal)
D) os baixos níveis de fibrinogênio (< 100 mg/dL) trata-se com crioprecipitado
A desmopressina o ácido epsilon-aminocapróico e a aprotinina também podem ser usados, embora geralmente sejam restritos aos pacientes de alto risco.
F. EXTUBAÇÃO
É desejável iniciar o processo de desmame ventilatório:
CONDIÇOES:
SUPORTE RESPIRATORIO:
O paciente deve
TESTE CONFIABILIDADE: habilidade em manter um pH arterial maior que 7,35 enquanto a frequência ventilatória mandatória intermediária está reduzida a zero
O paciente precisa ser encorajado a respirar profundamente e usar a espirometria de incentivo. Uma função pulmonar pós-operatória subótima pode precisar de terapia adicional, inclusive emprego de broncodilatadores, mucolíticos e fisioterapia torácica.
Após a extubação é importante proporcionar ao paciente alívio suficiente da dor para minimizar o estresse emocional, a tosse escassa e a relutância em iniciar a deambulação. Uma dor não-aliviada também pode ser fonte de taquicardia, hipertensão e isquemia miocardica.
Antes de deixar a UTÏ, os cateteres desnecessários devem ser removidos. A remoção dos cabos de marcapassos atriais e ventriculares temporários muitas vezes é adiada para o terceiro dia de pós-operatório.
MISODOR, 04 DE JANEIRO 2009